Kumpulan Soal dan Pembahasan tentang Pengertian, Hukum dan Tetapan Kesetimbangan Kimia
Soal 1 : Menentukan Jenis Reaksi Kesetimbangan
Perhatikanlah reaksi reaksi dibawah ini!
A. 2NaHCO3(s) <=> Na2CO3(s) + H2O(l) + CO2(g)
B. Fe3+(aq) + SCN-(aq) <=> Fe(SCN)2+ (aq)
C. CaCO3(s) <=> CaO(s) + CO2(g)
D. Ni(s) + 4CO(g) <=> Ni(CO)4(g)
E. AgCl(s) <=> Ag+(aq) + Cl-(aq)
Manakah yang termasuk kedalam reaksi kesetimbangan homogen?
Pembahasan :
Pertama marilah kita lihat terlebih dahulu jenis reaksi kesetimbangan. Berdasarkan wujud zat dalam persamaan reaksi yang setimbang, maka kesetimbangan kimia itu dibagi menjadi dua jenis yaitu :
1. Kesetimbangan homogen = Satu macam wujud zat dalam persamaan reaksi yang setimbang.
2. Kestimbangan Heterogen = Kebalikan dari pengertian diatas jika dalam persamaan reaksi yang setimbang terdapat lebih dari satu jenis wujud zat.
Nah, dari pengertian tersebut sudah jelaskan. kalian tentu sudah bisa memilih mana yang termasuk kedalam reaksi kesetimbangan homogen yaitu reaksi option B saja yaitu semua wujud spesi dalam persamaan reaksinya adalah (aq = larutan). Sedangkan reaksi option A, C, D dan E adalah reaksi kestimbangan heterogen karena terdapat lebih satu jenis wujud zat pada reaksi setimbangnya.
Oke soal selanjutnya ya.
Soal 2 : Pengertian Kesetimbangan Kimia
Suatu sistem kesetimbangan bersifat dinamis miksroskopis, berarti . . . . .
A. tidak terjadi perubahan dan dapat diukur
B. Perubahan berlangsung terus menerus dan dapat dimamati
C. Reaski terus berlangsung kekanan dan kekiri serta dapat diamati
D. Reaksi terus berlangsung kekanan dan kekiri tetapi tidak dapat diamati
E. Perubahan berlangsung terus menerus dan tiba tiba berhenti sehingga tidak dapat diukur
Pembahasan :
Oke marilah kita mulai menjawabnya dengan mempelajari jenis reaksi kimia berdasarkan sifat berlangsungnya reaksi yaitu ada yang irreversible(tidak dapat balik) dan ada yang reversible (dapat balik). Reaksi reversible ini memmungkinkan reaktan untuk membentuk produk dan sebaliknya seketika produk akan membentuk reaktan kembali. Artinya lagi reaksi ini terjadi bolak balik secara terus menerus maka reaksi yang seperti ini akan kita golongkan dalam reaksi yang kesetimbangannya dinamis (terus menerus berubah).
Contoh Kesetimbangan Dinamis
Pernahkan kalian melihat gelas berisi air yang ditutup. Peristiwa apa yang terjadi pada air dalam gelas tersebut?? Kita anggap saja sistemnya tertutup sehingga molekul air tidak dapat keluar dari wadah gelas yang tertutup tadi. Lama kelamaan, molekul air yang berwujud cair dalam gelas akan menguap, dan uap airnya akan mengisi ruang kosong diatas gelas tadi. Jika dibiarkan lama tentu jumlah air yang menguap akan semakin banyak sehingga sistem yang berda diatas permuakan air tadi akan penuh sesak oleh ua air. Karena terlalu banyak molekul uap air, maka sebgaian uao air tadi akan mengembunkembali membentuk air. Adanya air yang menguap, dan adanya uap air yang mengembunakan meciptakan suatu reaksi reversibel, sehingga terciptalah suatu kesetimbanagn dinamis.
Masih banya lagi contoh kesetimbangan dinamis. Kalian bisa cari tau sendiri kan. . . .jangan malas ya. . .
Soal 3 : Menentukan Kapan Suatu Reaksi Mencapai Kesetibangan
Perhtaikanlah reaksi diabawah ini.
4NH3(g) + 5O2(g) <=> 4NO(g) + 6H2O(g)
Reaksi tersebut akan mencapai kesetimbangan pada saat . . . . .
A. Semua NH3 berubah menjadi NO
B. Laju reaksi ke kanan sama dengan laju reaksi kekiri
C. Jumlah mol reaktan sama dengan jumlah mol produk
D. Jumlah mol produk lebih besar dibandingkan jumlah mol reaktan
E. Massa zat hasil reaksi sama dengan massa zat pereaksi
Pembahasan :
Wah soal ini tergolong mudah ya. Jika kalian bisa menalarnya maka kalian akan menemukan jawaban yang tepat.
Tanda panah dua (<=>) pada persamaan reaksi kesetimbangan diatas adalah tanda arah reaksi. Karena ada dua buah, panah kekanan artinya reaksi pembentukan produk (NO dan H2O) sementara tanda panah kekiri menunjukkan reaksi pembentukan reaktan (NH3 dan O2). Masing masing reaksi ini tentu memiliki laju reaksinya masing masing. Kapan reaksinya dalam keadaan setimbang, ketika laju reaksi pemebntukan produk (kanan) sama dengan laju pembentukan reakstan (kiri). Ketika lajunya sama maka perubahan yang terjadi tdak akan dapat diamati secara kasat mata melainkan dengan cara mikroskopis.
Paham ya . . . .
Soal 4 :Mebuat Permasaan tetapan kesetimbangangan (Kc)
Diketahui reaksi kesetimbangan berikut,
4HCl(g) + O2(g) <=> 2H2O(g) + 2Cl2(g)
Persmaan tetapan kesetimbangan Kc untuk reaksi tersebut adalah . . . .
Pembahasan :
Konstanta kestimbangan (Kc) menurut hukum kesetimbangan yang dikemukakan oleh Guldberg dan Waage adalah hasil bagi antara konsentrasi produk dipangkatkan koefieinnya dengan konsentrasi reakstan dipangkatkan koefisiennya.
Secara umum, pada reaksi kesetimbangan :
mA + nB <=> oC + pD
Persamaan tetapan kesetimbangannya adalah :
Kc = [C]^o [D]^p / [A]^m [B]^n
Kembali kesoal diatas. Reaski yang diberikan adalah :
4HCl(g) + O2(g) <=> 2H2O(g) + 2Cl2(g)
Berati konstanta kesetimbangannya adalah :
Kc = [H2O]^2 [Cl2]^2 / [HCl] ^4 [O2]
Mudah kan. Oh ya hampir saja lupa, kan yang dimasukkan kedalam konstanta kesetimbangan itu adalah konsentrasi kan. Diban laju reaksi sebelmnya kita sudah bahas bahwa konsentrasi itu adalah mol dibagi volume. Zat zat yang mempunyai konsentrasi dan volume adalah zat dalam wujud (g) dan (aq) saja ya. Karena untuk zat yang wujudnya (s) dan (l) konsentrasinya selalu tetap karena volumenya tidak berubah. Ingat itu ya.
Perhatikan Soal berikut ini:
Soal 5 : Menulis Permasaan Konstanta Kestimbangan
Diberikan reaksi sebagai berikut.
Fe3O4(s) + CO(g) <=> Fe(s) + CO2(g)
Persmaan tetapan kesetimbangan dari reaksi diatas adalah?
Pembahasan :
Ayo. . . terlihat mudah kan. Tapi kalian jangan terkecoh dengan soal diatas. Perhatikan reaksinya, ternyata belum setara. Jadi tugas pertama kita adalah menyetarakan reaksi tersebut. Untuk menyetarakan sudah kalian pelajari dikelas 10, jadi saya anggap sudah bisa ya. . .
Persamaan reaksi setara untuk reaksi diatas adalah.
Fe3O4(s) + 4CO(g) <=> 3Fe(s) + 4CO2(g)
Maka persamaan tetapan ketimbangannya adalah.
Kc = [CO2]4 / [CO]4
Ingat ya yang kita ambil hanya zat yang wujudnya (aq) dan (g) saja.
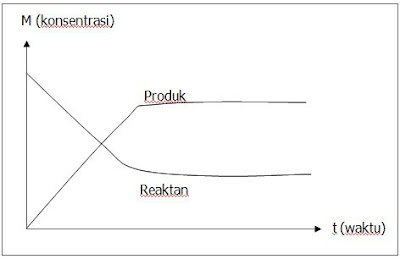
Soal 6 : Grafik reaksi kesetimangan
Diberikan reaksi kesetimbangan sebagai berikut.
P(aq) + Q(aq) <=> PQ(aq)
Bagaimana grafik hubungan konsentrasi dengan waktu reaksi apabila dalam keadan setimbang konsentrasi reaktan lebih kecil dibandingkan konsentrasi produk?
Pembahasan :
Jika konsentrasi reaktan lebih kecil dibandingkan produk, maka grafik yang mewakili adalah :
Penjelasan grafik
Pada awal reaski konsentrasi reaktan maksimal, semakin lama semakin berkurang. Saat kesetimbangan tercapai konsentrasi reakstan tidak berubah. Sementara itu konsentrasi produk yang semula nol semakin lama semakin bertambah hingga konstan pada saat kesetimbangan.


Posting Komentar untuk "Kumpulan Soal dan Pembahasan tentang Pengertian, Hukum dan Tetapan Kesetimbangan Kimia"